COCAINA
metil
(1R,2R,3S,5S)-3-(benzoiloxi)-8-metil-8-azabiciclo[3.2.1]octano-2-
carboxilato de metilo
carboxilato de metilo
Se obtiene de la planta de coca
Erythroxylum coca
Originaria de los Andes amazónicos.
Propiedades
•
Punto de fusión: 98 °C
•
Punto de ebullicion:187 °C
•
Polaridad: Medianamente polar
•
Es muy soluble en cloroformo y soluble en
etanol, en éter dietilico, acetona, ácido acético y petróleo, es muy poco
soluble en agua fría, también es insoluble en glicerina.
•
Cristaliza en etanol
Formas de consumirla
·
Inyectada
·
Inhalada
·
Fumada
Los efectos mentales
·
Sensación de certeza o euforia
·
Sensación de felicidad
·
Paranoia.
Síntomas a nivel físico
·
Pupilas dilatadas
·
Sudoración o escalofríos
·
Frecuencia cardiaca alta
Como funciona a nivel neuronal
La cocaína principalmente tapa los receptores possinápticos donde
entra el NT de dopamina el cual se encarga de la sensación de placer.
Consecuencias
La cocaína aumenta el riesgo de sufrir derrame cerebral,
acelera la arterioesclerosis y provoca paranoia transitoria en la mayoría
de los adictos. El uso continuo mediante la aspiración nasal de la cocaína
(esnifar) puede producir congestión nasal, ulceración de la membrana mucosa,
hasta incluso perforación del tabique nasal. También puede provocar impotencia
sexual o disfunción eréctil.
Datos
Después del cannabis, la cocaína es la droga ilegal más
consumida a nivel mundial;18 19 entre 18 y 22 millones de personas
utilizaron la sustancia en 2014 y América del Norte es su principal consumidor,
seguido de Europa y América del Sur. Se estima que entre el 1 y el 3% de los habitantes
del mundo desarrollado han probado la cocaína en algún momento de su vida.
Aplicación Farmaceutica
•
Anestésico
•
Pero al ser adictiva no se usa
•
Complicaciones:Estímulo potente del SNC por
acción dopaminérgica.
•
se produce incremento del tono vital y de la
energía, disminución del apetito, insomnio, aumento del rendimiento intelectual
y físico, hiperactividad motora, verbal e ideatoria, disminución de la
fatigabilidad e incremento de los placeres en alerta.
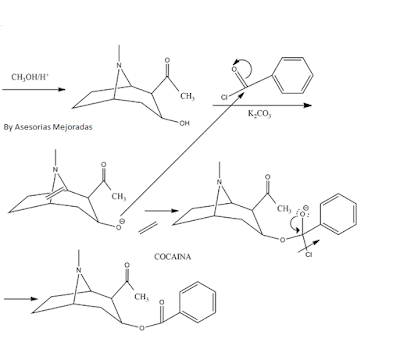
Sintesis de cocaina
Mecanismo de Reaccion
Bibiografia
•
https://www.drugabuse.gov/es/publicaciones/serie-de-reportes/cocaina-abuso-y-adiccion/como-se-consume-la-cocaina
•
http://www.quimicaorganica.org/sintesis-organica/640-sintesis-de-anestesicos-locales-derivados-del-acido-benzoico.html